
Klinik für diagnostische und interventionelle Radiologie
Chefarzt Prof. Dr. Matthias Bollow
Augusta-Kranken-Anstalt gGmbH
Bergstraße 26 - 44791 Bochum
Tel.: 0234 / 517-2753

Klinik für diagnostische und interventionelle Radiologie
Chefarzt Prof. Dr. Matthias Bollow
Augusta-Kranken-Anstalt gGmbH
Bergstraße 26 - 44791 Bochum
Tel.: 0234 / 517-2753

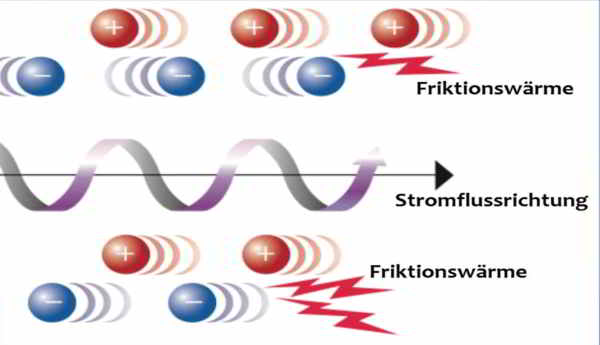
Das Osteoidosteom besteht aus einem kleinen Nidus aus Osteoblasten und Osteoid mit einer umgebenden Sklerose und weist eine periphere nervale und vaskuläre Versorgung auf. Das Osteoidosteom macht 4 % aller Knochentumoren aus und tritt als dritthäufigster gutartiger Knochentumor nach dem Osteochondrom (12 %) und dem Enchondrom (10 %) in Erscheinung. Die Altersprädilektion liegt zwischen dem fünften und 25. Lebensjahr, es werden jedoch auch ältere Patienten mit einem Osteoidosteom diagnostiziert, wobei das Geschlechterverhältnis zwischen Männern und Frauen 2 zu 1 beträgt. Grundsätzlich können Osteoidosteome in allen Skelettabschnitte vorkommen. Hauptlokalisationen sind neben den langen Röhrenknochen vor allem der unteren Extremität die Wirbelkörper-Anhangsgebilde des Achsenskelettes. Die Patienten klagen zumeist über ausgeprägte lokale nächtliche Schmerzen, die von Prostaglandinen ausgelöst werden, welche durch den Tumor-Nidus exzessiv produziert werden. Diese Prostaglandin-Synthese löst lokale Entzündungsreaktionen mit Vasodilatationen aus und kann unbehandelt bereits nach wenigen Monaten zu einem lokal abnormen Knochenwachstum und bei gelenknahem Auftreten zu rheumaähnlichen Symptomen mit Synovitiden führen. Typischerweise führt die Behandlung mit Prostaglandin-Inhibitoren wie den nichtsteroidalen Antiphlogistika bzw. Antirheumatika NSAR (z.B. Acetylsalicylsäure) zu einer signifikanten Beschwerdelinderung, welches differenzialtherapeutisch genutzt wird. Die Therapie der Wahl eines Osteoidosteoms ist die perkutane Radiofrequenzablation, deren Konzept auf der Entwicklung von Friktionswärme (60-100°C) beruht, die durch Aneinander-Reibungen der Ionen als Folge von schnellen Richtungsänderungen der Ladung bei Anlegen eines hochfrequenten Wechselstroms an der Spitze einer in den Tumor vorgeschobenen Thermosonde entsteht:
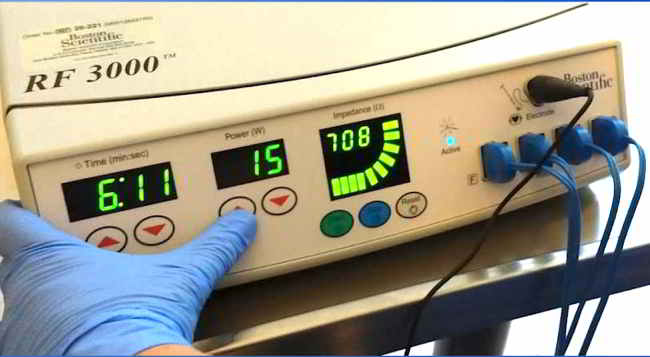
Zur Vorbereitung der Radiofrequenzablation werden Neutralelektroden an den Oberschenkeln der Patienten zur Ableitung des Wechselstromes angebracht und am Generator angeschlossen. Diese Ableitelektroden am Oberschenkel werden regelmäßig während der Therapie überprüft und gegebenenfalls zusätzlich mit Kühlaggregaten zur Vermeidung von Überhitzungen an der Haut versehen:

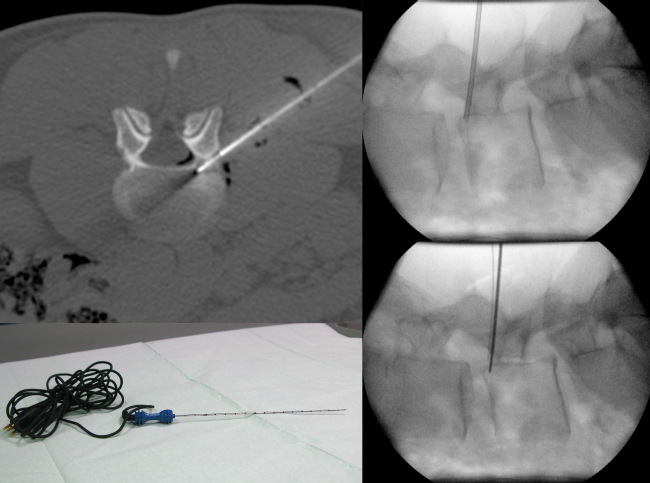
Bei der perkutanen Radiofrequenzablation wird unter Narkose und CT-Kontrolle der für die Schmerzen ursächliche Osteoidosteom-Nidus in koaxialer Technik von perkutan mittels einer Knochenpunktions-Kanüle sondiert und im Anschluss eine Thermosonde (Abb. 1 a-c, 2 a-c) mit ihrer aktiven Spitze durch diese koaxiale Kanüle vorgeschoben und zentral im Osteoidosteom platziert. Durch Zurückziehen der Koaxialnadel wird die aktive Spitze der Thermosonde freigegeben, um eine vollsta¨ndige thermische Destruktion des Nidus zu ermo¨glichen. Bei dieser Methode wird in den Nidus ein hochfrequenter elektrischer Wechselstrom (375–480 kHz) u¨ber einen nicht isolierten Anteil der Thermosonde verabreicht, wobei es im Gewebe zur Ionenagitation kommt, welche in manchen Fällen durch die vorherige Gabe von wenigen Millilitern einer hypertonen (20%igen) NaCl-Lösung über die koaxiale Kanüle verbessert werden kann. Da die Ionen den Richtungsänderungen des Wechselstroms folgen resultiert eine Reibungshitze, die zur Koagulation des Nidus führt, da nur das die Elektrode umgebende Gewebe und nicht die Elektrode selber erhitzt wird. Diese Thermokoagulation wird mit Hochfrequenz-Leistungen von zuerst 2 Watt für eine Minute unter Erhöhungen der Hochfrequenz um jeweils ein Watt pro Minute mit den jeweiligen Impedanz-Anstiegen nach einer Zeit von durchschnittlich 5 bis maximal 15 Minuten bei ca. 90° C bis zum sog. „Roll-Off“ durchgeführt:
Nach anschließender Entfernung der Thermosonde wird zur postinterventionellen Schmerztherapie ein Lokalana¨sthetikum (z. B. Bupivacain 0,25 %) durch die Koaxialkanüle verabreicht, welche im Anschluss ebenfalls entfernt wird. Bei diesem Verfahren ist zu beachten, dass die Thermosonde von keinem Anteil des Nidus mehr als 6 mm entfernt liegt, so dass bei Nidus-Durchmessern von mehr als 10–12 mm die Radiofrequenzablation nach Umplazierungen mehrere Male wiederholt werden muss, um alle Anteile des Nidus zu abladieren. Vorteil dieser Behandlung gegenüber chirurgischen Eingriffen ist der sehr schmale kno¨cherne Zugangsweg mit der nur geringen Schädigung des Knochens, so dass der Knochen dadurch seine Stabilita¨t behält und sofort postinterventionell selbst bei der Behandlung an Füssen und Knöcheln belastet werden kann. Auch im Falle von Rezidiven lassen sich diese in der Regel problemlos erneut einer Radiofrequenzablation unterziehen. Als mögliche Komplikationen wurden Hautverbrennungen insbesondere bei Tumorlokalisationen mit Abständen von weniger als 1 cm von der Kutis am ha¨ufigsten beschrieben. Zur Vermeidung thermischer Schäden sollte daher bei Lokalisationen von Osteoidosteomen in Angrenzung an wichtige neuronale oder vaskula¨re Strukturen ein Sicherheitsabstand von mindestens 1 cm eingehalten werden, so dass vor allem La¨sionen an der Wirbelsa¨ule und an den Händen Kontraindikationen fu¨r die Radiofrequenzablation darstellen können. Bei der Radiofrequenzablation von Osteoidosteomen an der Wirbelsäule (Abb. 2 a-c) kann durch Applikation eines sog. Luftkissens eine Protektion gegen thermische Schäden an Nerven und Rückenmarkhäuten sinnvoll sein. Die publizierten primären und sekundären Erfolgsraten dieser Technik lagen zwischen 83% und 100%. Chirurgische Resektion und offene Kürettage zeigten vergleichbare Erfolgsraten, waren aber mit höheren Komplikationsraten verbunden. Darüber hinaus ist die bildgeführte Radiofrequenzablation von Osteoidosteomen mit geringeren Kosten als die chirurgischen Methoden verbunden, so dass diese Methode als Goldstandard für die Behandlung von Osteoidosteomen angesehen werden kann.
 |
|
| Abb.1a |
 |
|
| Abb.1b |
 |
|
| Abb.1c |
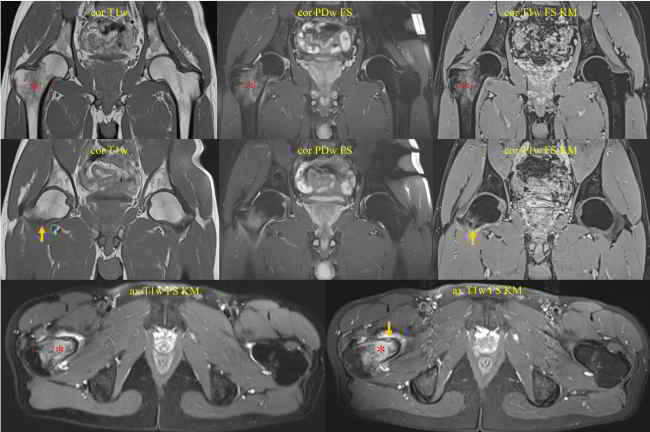
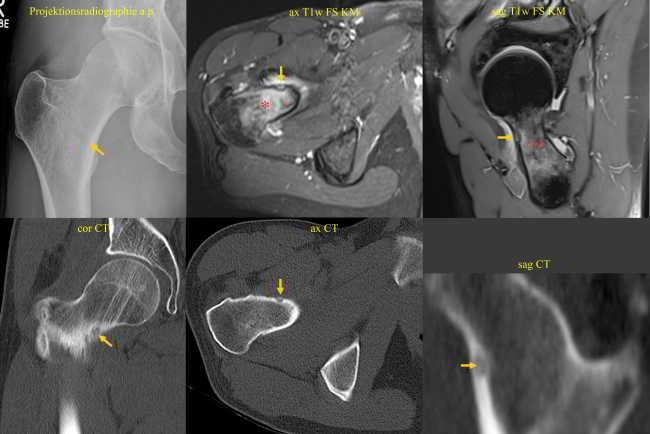
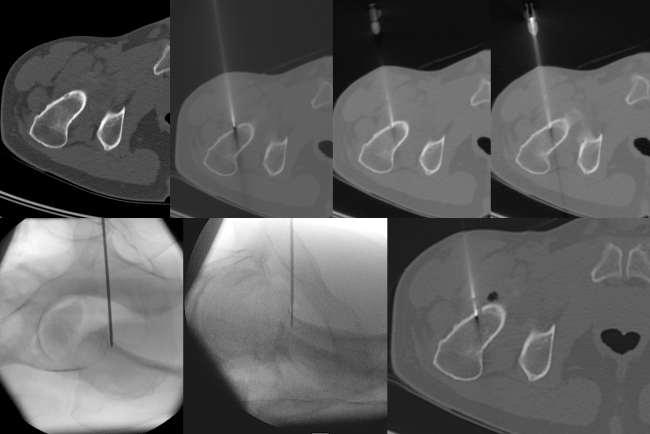
Bildlegenden Abb. 1 a-c Radiofrequenzablation eines subperiostalen Osteoidosteoms ventral im Schenkelhals am proximalen Femur rechts. Diagnostik und Therapie eines Patienten mit NSAR-sensitiven Schmerzen an der rechten Hüfte seit ½ Jahr VAS 9. Die MRT wurde u.a. unter Anwendung einer coronaren T1gew. THRIVE-Sequenz nach Kontrastmittelgabe, einer axialen T1-gew. fettgesättigten SPIR-Sequenz nach Kontrastmittelgabe und einer sagittalen PD-gew. fettgesättigten TSE-Sequenz Schichtorientierung durchgeführt. Zur Darstellung kamen ausgedehnte Osteitiden (Sterne) im Femurkopf-Schenkelhals-Übergang mit Synovitiden im rechten Hüftgelenk und eine ventral subperiostal bis kortikal gelegene 4 x 5 mm große kontrastmittel-enhancende Strukturstörung (Pfeile). Trotz des untypischen Alters wurde in Zusammenschau mit der Klinik der Verdacht auf ein Osteoidosteom gestellt, da bei diesem Patienten bereits im Alter von 36 Jahren ein Osteoidosteom am Ellenbogen detektiert und therapiert worden war. Bei der Verdachtsdiagnose eines Osteoidosteoms wurde eine Mehrzeilenspiral-CT der Hüftgelenke in Low Dose Technik mit coronarer Rekonstruktion, transversaler Darstellung und sagittaler Rekonstruktion angeschlossen, in welcher sich randsklerosierte subperiostale bis kortikale Läsion mit hyperdensem verkalktem Nidus ventral am Schenkelhals rechts (Pfeil) bestätigen ließ. Daher wurde unter Intubationsnarkose und unter sterilen Bedingungen und Lokalanästhesie unter CT-Kontrolle zuerst mit einer 2,4 mm durchmessenden Ostycut-Biopsie-Kanüle eine Trepanation der Kompakta mit dem Ziel einer Biopsie des Nidus durchgeführt, welche histologisch am Folgetag als Osteoidosteom bestätigt werden konnte. Im Anschluss wurde eine Hochfrequenz-Ablation bzw. Radiofrequenzablation des Osteoidosteoms durchgeführt, wobei nach Positionierung einer koaxialen CoAccess TM-Kanüle eine SoloistTM (Boston Scientific) Single-Needle Elektrode unter CT-Monitoring und Fluoroskopie-Monitoring bis an den Nidus herangeführt und mit Hochfrequenz-Leistungen von zuerst 2 Watt für eine Minute unter Erhöhungen der Hochfrequenz um jeweils ein Watt pro Minute mit Impedanz-Anstiegen bis zum Erreichen des sog. „Roll-Off“ nach einer Zeit von 16 Minuten erreicht werden konnte. Nach Erreichen eines zweiten „Roll-Off“ wurde die koaxial eingeführte Elektrode entfernt und über die verbliebene CoAccess TM-Kanüle eine zusätzliche sog. „perkutane Alkoholablation“ (Percutaneous Ethanol Injection Therapy PEIT) mit 3 ml eines 95%igen Alkohols angeschlossen. Nach Entfernung der Kanüle konnte der Patient in der Obhut der Anästhesie in den Aufwachraum entlassen werden. Der Patient war nach der Behandlung und auch nach Befragen ein Jahr später vollständig beschwerdefrei.
 |
|
| Abb.2a |
 |
|
| Abb.2b |
 |
|
| Abb.2c |
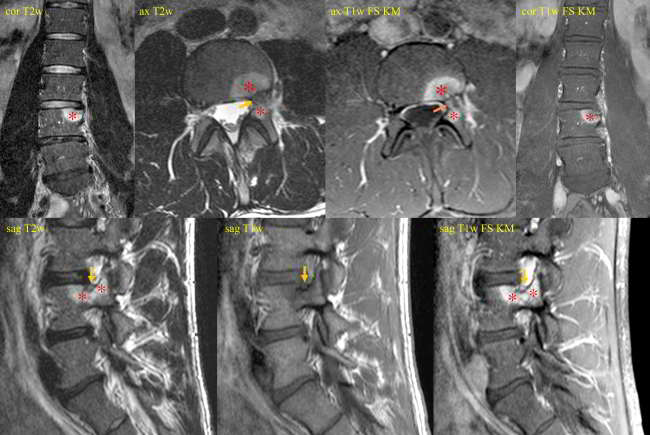
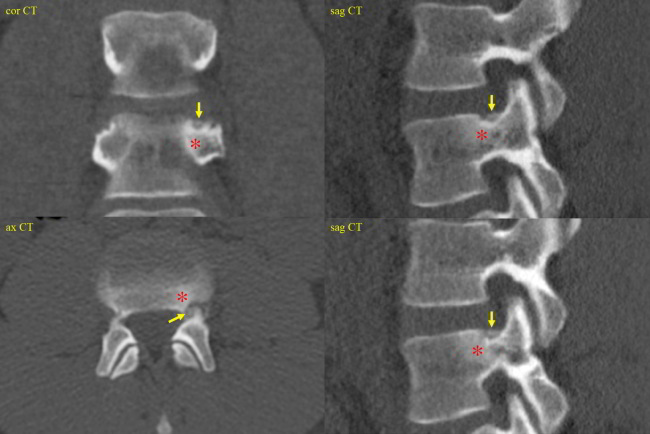
Bildlegenden Abb. 2 a-c MR-tomographische und CT-morphologische Darstellung eines 5 x 4 mm großen Osteoidosteom (Pfeile) mit einem zentral verkalkten 1,5 mm großen Nidus kranial im linken Pediculus arcus vertebrae von LWK 4 bei einem jungen Patienten mit nächtlichen starken Schmerzen (VAS 9) seit fünf Monaten, welche bisher mit einer NSAR-Dauertherapie behandelt wurden. In der MRT zeigte die Läsion eine ca. 30 x 25 mm große umgebende knochenmarködem-äquivalente Osteitis (Sterne), welche mit einem CT-morphologisch erkennbaren mattglasartigen Sklerosesaum korrelierte. Durchführung der Radiofrequenzablation in der CT mit simultaner Fluoroskopie mittes eines C-Bogens am CT in Vollnarkose in Bauchlage. Nach Darstellung des Osteoidosteoms durch eine hoch aufgelöste Mehrzeilenspiral-CT mit koronaren und sagittalen Rekonstruktionen wurde unter sterilen Bedingungen und unter zusätzlicher lokaler Anästhesie zuerst unter Fluoroskopie- und CT-Monitoring mit einer 2,4 mm durchmessenden Ostycut-Biopsiekanüle ein Knochenkanal von links dorsolateral zum Nidus gebohrt und eine Gewebeprobe aus der Nachbarschaft des Nidus entnommen. Im Anschluss wurde eine Hochfrequenz-Ablation bzw. Radiofrequenzablation des Osteoidosteoms durchgeführt, wobei nach Positionierung einer koaxialen CoAccess TM-Kanüle am Nidus zunächst 2 ml 20%ige Kochsalzlösung über diese Hohlnadel an den Nidus zum Zwecke einer Bereitstellung eines höheren Ionenangebotes appliziert wurde und dann eine sog. Soloist TM (Boston Scientific) Single-Needle-Radiofrequenz-Elektrode (Abbildung) unter CT-Monitoring und Fluoroskopie-Monitoring bis an den Nidus herangeführt wurde. Über eine parallel in der Nachbarschaft des Nidus im Neuroforamen platzierte 0,9 mm durchmessende Shiba-Kanüle erfolgten Luftinjektionen zum Erreichen eines protektiven Luftpolsters zur Schonung der Nervenwurzel L3 links einerseits und der Rückenmarkhäute andererseits. Erst danach wurde mit Hochfrequenz-Leistungen von zuerst 2 Watt für eine Minute unter Erhöhungen der Hochfrequenz um jeweils ein Watt pro Minute mit Impedanz-Anstiegen nach einer Zeit von 10 Minuten der sog. „Roll-Off“ erreicht. Nach Umpositionierung der Elektrodenspitze um 3 mm und nach Erreichen eines zweiten „Roll-Off“ wurde die koaxial einliegende Elektrode entfernt und über die verbliebene CoAccess TM-Kanüle eine zusätzliche sog. „perkutane Alkoholablation“ (Percutaneous Ethanol Injection Therapy PEIT) mit 1,5 ml eines 95%igen Alkohols angeschlossen. Nach Entfernung der Kanüle und nach Anlage eines sterilen Pflasterverbandes konnte der Patient in der Obhut der Anästhesie in den Aufwachraum entlassen werden. Der Patient war nach der Radiofrequenzablation beschwerdefrei.
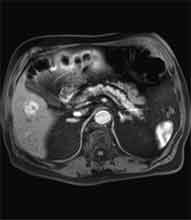
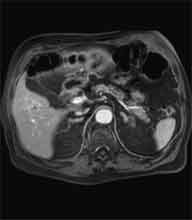
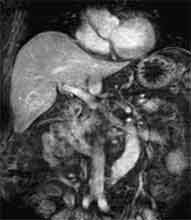
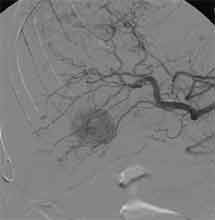
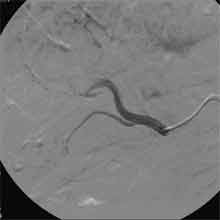
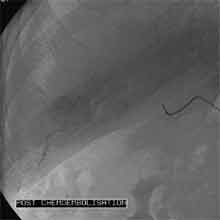
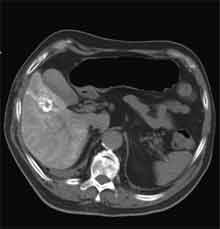
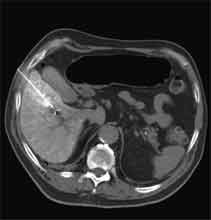
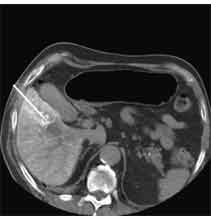
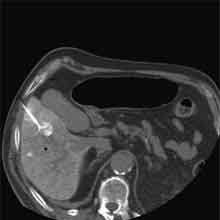
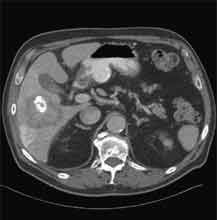
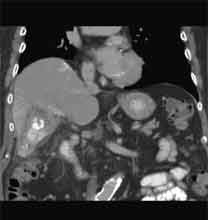
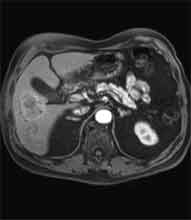
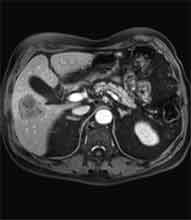
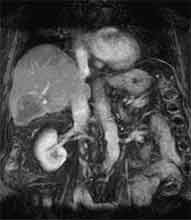
Bei der Radiofrequenztherapie handelt es sich um ein lokales Verfahren, durch welchen ein Tumor oder eine Metastase durch Hitze zerstört wird. Die Hitze wird durch eine Sonde erzielt, die unter CT-Kontrolle in den Tumor eingebracht wird. Durch einen Radiofrequenzgenerator wird ein hochfrequenter Wechselstrom erzeugt, der über die Sonde zu einem Temperturanstieg im Gewebe auf 90 bis 120°C führt. Der Tumor wird hierdurch bei einer Temperatur in der Tumormitte von ca. 100 °C an Ort und Stelle "verkocht". Der Vorteil der Radiofrequenzablation liegt in dem wählbaren Durchmesser der Sonden bzw. expandierbaren Schirmelektroden (von 2 cm bis 5 cm) und der erzielbaren Läsionsgröße (bis 5 cm ohne Sondenverlagerung). Die Kontrolle der Tumorzerstörung erfolgt über eine Bestimmung der Leitfähigkeit des Gewebes (Impedanz) während des Eingriffs, welches über die liegende Sonde selbst erfolgt. Durch zweimalige Erhitzung des Tumors bis zum jeweiligen Erreichen eines Impedanzanstiegs werden die Tumoren erfolgreich devitalisiert. Nach erfolgreicher Tumorbehandlung wird der Punktionsweg während der Sondenentfernung koaguliert, d.h. durch die Hitze verschlossen, so dass eine Tumorzellverschleppung nicht auftreten kann. Da die Hitzebehandlung von Metastasen oder Tumoren je nach Lage und Organ schmerzhaft sein kann, erfolgt der Eingriff unter Narkose. Die Dauer des Eingriffs beträgt je nach Größe und Anzahl der behandelten Metastasen zwischen einer und drei Stunden. Das Behandlungsergebnis wird durch CT- u/o MRT-Verlaufskontrollen unmittelbar nach der Intervention sowie drei, sechs und 12 Monate nach dem Eingriff kontrolliert (Abb. 1.4.). In unserem Institut wird die Radiofrequenzablation von fokalen Leberläsionen in der Regel mit einer vorausgehenden selektiven transarteriellen Chemoembolisation (TACE) kombiniert, wobei über den intrahepatischen tumorversorgenden Ast der Arteria hepatica ein Katheter platziert wird, über welchen eine Embolisation bis zur Stase durchgeführt wird. Die ischämische, d.h. sauerstoffentziehende Wirkung wird durch zugesetzten Zytostatika noch verstärkt. Abb. 1.4. a-e: Chemoembolisation und Radiofrequenzablation eines histologisch gesicherten HCC im Segment V/VI-Übergang des rechten Leberlappens: a) Vor Therapie axiales MRT 30 Sek. post KM (Kontrastmittel) mit Nachweis einer arteriellen Hypervaskularisation b) Vor Therapie axiales MRT 120 Sek. post KM c) Vor Therapie coronares MRT 180 Sek. post KM d) Selektive transarterielle Mikrokatheterisierung mit Kontrastierung der intrahepatischen Arteria hepatica-Segmente V und VI via Truncus coeliacus: Darstellung des arteriell hypervaskularisierten HCC e) Bild der zu erreichenden „Stase“ in den Gefäßsen während der Chemoembolisation, an welcher die Chemoembolisation beendet wird f) Abschlußbild post-Chemoembolisation mit durch Lipoidol markiertem Tumorkern g) Beginn der CT-gesteuerten RITA unmittelbar nach Abschluß der Chemoembolisation: Das HCC ist durch Lipoidaleinlagerungen nativdiagnostisch in der CT gut abgrenzbar, h-j Dokumentationen mehrfacher Lagewechsel der Schirmchenelektrode um den Tumor und im Tumor selbst mit jeweils zweimaligen Erhitzungen am Ort bis zum jeweiligen Erreichen eines Impedanzanstiegs, k-l Kontrastmittelgestütztes Kontroll-CT (axial und coronar) einen Tag nach der kombinierten Chemoembolisation und Radiofrequenzablation: Die Lipoidoleinlagerung im Tumorkern ist noch sichtbar. Nachweis einer Devitalisierung des peritumoralem Leberparenchyms mit einem ausreichenden Sicherheitsabstand zum Tumorkern (m) Ein Jahr nach Therapie axiales MRT 30 Sek. post KM (n) Nachweis einer persistierenden Nekrose mit Schrumpfungstendenz im therapierten Areal ohne Hinweise auf ein hypervaskularisiertes Tumorrezidiv oder eine Zweittumorbildung. Im axialen MRT 120 Sek. (n) und im coronaren MRT 180 Sek. (o) post KM auch keine Zeichen eines hypovaskularisierten Tumors.
 |
 |
 |
|||
| Abb. 1.4. a | Abb. 1.4. b | Abb. 1.4. c |
 |
 |
 |
|||
| Abb. 1.4. d | Abb. 1.4. e | Abb. 1.4. f |
 |
 |
 |
|||
| Abb. 1.4. g | Abb. 1.4. h | Abb. 1.4. i |
 |
 |
 |
|||
| Abb. 1.4. j | Abb. 1.4. k | Abb. 1.4. l |
 |
 |
 |
|||
| Abb. 1.4. m | Abb. 1.4. n | Abb. 1.4. o |
Durch den vermehrten Einsatz von Bildgebung (Sonographie, CT, MRT) stieg in den letzten Jahren die Erkennungrate von auch kleineren Nierenzellkarzinomen, welche von den Urologen erfolgreich organerhaltend reseziert werden konnten ( Homepage Urologie). Da diese erhöhte Erkennungsrate auch zunehmend ältere Patienten mit hohem operativen Risiko betraf, erfolgten in den letzten Jahren nach jeweils gemeinsamer Indikationsstellung seitens der Urologen und Radiologen bei solchen Patienten mit erhöhter Komorbidität CT-gesteuerte Radiofrequenzablationen von bösartigen Nierentumoren. In der Literatur wird von einer Tumorfreiheit von 90% nach zwei Jahren bei komplikationslosen Einsätzen unter Erhalt der Nierenfunktion bei 23 Patienten mit Nierenzellkarzinomen mit einem mittleren Alter von 74 Jahren berichtet (Arzola J u. Mitarb. Urolgy 2006; 68: 983-987). Bei der Radiofrequenztherapie handelt es sich um ein lokales Verfahren, durch welches ein Nierentumor durch Hitze zerstört wird. Die Hitze wird durch eine Sonde erzielt, die unter CT-Kontrolle in den Tumor eingebracht wird. Durch einen Radiofrequenzgenerator wird ein hochfrequenter Wechselstrom erzeugt, der über die eingebrachte Schirmelektrode zu einem Temperturanstieg im Gewebe auf 90 bis 120°C durch vermehrte Ionenbewegungen entlang der Feldlinien (nicht durch Erhitzen der Elektrode selbst) führt. Ein Nierenzellkarzinom wird hierdurch bei einer Temperatur in der Tumormitte von ca. 100 °C an Ort und Stelle "verkocht". Der Vorteil der Radiofrequenzablation liegt in dem wählbaren Durchmesser der expandierbaren Schirmelektroden (von 2 cm bis 5 cm) und der erzielbaren Läsionsgröße (bis 5 cm ohne Sondenverlagerung). Die Kontrolle der Tumorzerstörung erfolgt über eine Bestimmung der Leitfähigkeit des Gewebes (Impedanz) während des Eingriffs, welches über die liegende Sonde selbst erfolgt. Durch zweimalige Erhitzung des Tumors bis zum jeweiligen Erreichen eines Impedanzanstiegs werden die Tumoren erfolgreich devitalisiert. Nach erfolgreicher Tumorbehandlung wird der Punktionsweg während der Sondenentfernung koaguliert, d.h. durch die Hitze verschlossen, so dass eine Tumorzellverschleppung nicht auftreten kann. Da diese Hitzebehandlung von bösartigen Nierenzellkarzinomen schmerzhaft sein kann, erfolgt der Eingriff unter Narkose. Die Dauer des Eingriffs beträgt je nach Größe des behandelten Tumors zwischen einer und zwei Stunden. Das Behandlungsergebnis wird durch CT- u/o MRT-Verlaufskontrollen unmittelbar nach der Intervention sowie drei, sechs und 12 Monate nach dem Eingriff kontrolliert (Abb. 1.5).
 |
 |
|||
| Abb. 1.5. a | Abb. 1.5. b |
 |
 |
 |
||
| Abb. 1.5. c | Abb. 1.5. d | Abb. 1.5. e |
 |
 |
||
| Abb. 1.5. f | Abb. 1.5. g |
 |
 |
 |
||
| Abb. 1.5. h | Abb. 1.5. i | Abb. 1.5. j |
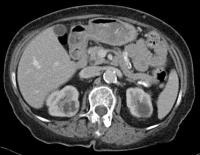
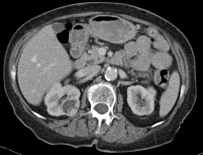
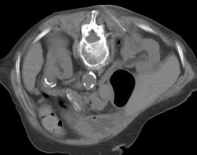
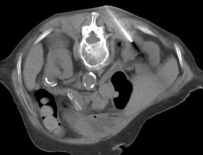
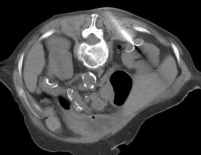
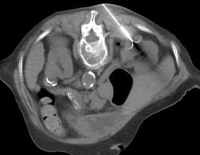
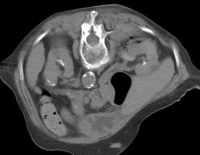
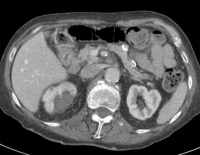
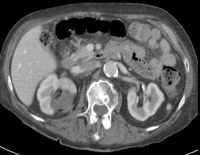
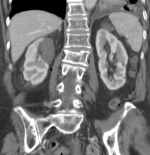
Abb. 1.5. a-j: Radiofrequenzablation eines 3 x 2,5 cm großen Nierenzellkarzinoms am oberen Nierenpol rechts bei einer 79-jährigen Patientin, welche wegen zusätzlicher kardialer Erkrankungen nicht operabel war: a+b) In einer auswärtigen CT wurden bilaterale Nierenzelltumoren detektiert, welche nacheinander behandelt werden sollten c-g) Dokumentationen der Radiofrequenzablationsschritte: c) Lokale Anästhesie d) Vorschieben der Koaxialnadel in das Tumorzentrum e+f) Einbrinung der 3 cm durchmessenden Schirmchenelektrode zentral in den Tumor über die zuvor geschobene Koaxialnadel. g) Nach jeweils zweimaliger Erhitzung am Ort bis zum jeweiligen Erreichen eines Impedanzanstiegs zeigte sich in der Kontrolle nach Entfernung der Elektrode eine Verkleinerung des Tumors. h-j) In einer kontrastmittelgestützten Kontroll-CT (axial / coronar) vier Tage nach der Radiofrequenzablation Bild einer kompletten Devitalisierung des Nierenzellkarzinoms.